Structure moléculaire de l’Eau
La molécule d'eau, H₂O, est composée de deux atomes d'hydrogène et un atome d'oxygène. Ceux-ci sont liés par des liaisons covalentes. Sa structure lui confère des propriétés uniques, ce qui explique sa nécessité dans la formation de la vie.
- Les savants ont d’abord pensé que l’eau étaient l’un des 4 éléments de base qui composaient tout matière. Il y avait le feu, l’air, la terre et l’eau. À partir du XVIe siècle, les scientifiques découvrent qu’il existe des airs différents. En effet, ils découvrent l’existence d’un air très inflammable. À cette époque, ils pensaient qu’un élément feu s’échappe dans toute matière que l’on brûle.
- Ainsi, le chimiste anglais Cavendish décide de s’intéresser à ce gaz. Il fait une expérience dans laquelle il arrive à isoler de l’air déphlogistiqué qu’il fait brûler avec de l’air inflammable. Il remarque que de l’humidité apparaît sur les parois du récipient puis en déduit que c’est de l’eau. Comme Cavendish pense que l’air inflammable est constitué d’eau et de phlogistique, et que l’air déphlogistiqué est de l’eau privé de phlogistique, il conclut qu’alliait ces deux gaz revient à compenser ce manque ce qui permet d’obtenir de l’eau.
- Le chimiste français Lavoisier travaillent sur cette même expérience mais il pense que c’est la réaction entre l’oxygène et l’air inflammable qui provoque l’humidité. Ce qu’il cherche, c’est les proportions nécessaires pour la formation d’eau. Il découvre qu’il faut un volume d’oxygène pour deux volumes d’air inflammable. Il décide alors d’appeler ce gaz : hydrogène.
- Ce n’est qu’à la fin du XIXe siècle que l’on comprend que l’eau a pour formule chimique H20.

Laboratoire de Lavoisier présenté au musée des arts et métiers¹
-
- L’eau est une molécule angulaire, en forme de « V ». Elle a pour atome centrale l’oxygène relié par des liaisons covalentes, deux atomes d’hydrogène. Chaque liaison a une longueur de 96 pm. Le doublet non liant de l’atome d’oxygène répulse les doublets liants. De ce fait, l’angle entre les deux liaisons O-H est de 104,5 ° alors qu’il vaudrait 109,5 ° dans un tétraèdre parfait.
L’atome d’oxygène capte plus fortement les électrons que l’hydrogène. L’atome d’oxygène est donc chargé négativement et l’atome d’hydrogène positivement. On dit que l’eau est une molécule polaire.
- Définition : « Une molécule polaire est une molécule qui ne partage pas uniformément les électrons à travers la liaison covalente et qui présente un dipôle sur les atomes impliqué »
- L’eau est une molécule angulaire, en forme de « V ». Elle a pour atome centrale l’oxygène relié par des liaisons covalentes, deux atomes d’hydrogène. Chaque liaison a une longueur de 96 pm. Le doublet non liant de l’atome d’oxygène répulse les doublets liants. De ce fait, l’angle entre les deux liaisons O-H est de 104,5 ° alors qu’il vaudrait 109,5 ° dans un tétraèdre parfait.
L’atome d’oxygène capte plus fortement les électrons que l’hydrogène. L’atome d’oxygène est donc chargé négativement et l’atome d’hydrogène positivement. On dit que l’eau est une molécule polaire.
- Les molécules d’eau peuvent se lier entre elles. Étant donné que la molécule est polaire, les charges opposées s’attirent. La charge négative de l’oxygène d’un atome se lie à la charge positive de l’hydrogène d’un autre atome. Ainsi des liaisons hydrogènes O – H se créent. Cette liaison est très importante pour les propriétés de l’eau.
- Propriété physique :
- Il faut savoir que la liaison hydrogène est directionnelle. Si deux molécules d’eau doivent se liées, les 3 atomes (deux atomes d’oxygène, un atome d’hydrogène) seront alignés
- Cette propriété lui confère un agencement à l’état liquide et à l’état solide.
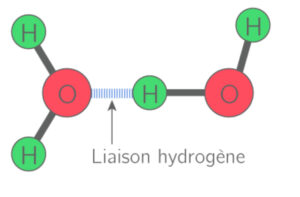 Liaison de deux molécules d’eau
Liaison de deux molécules d’eau
- Les liaisons hydrogènes permettent d’augmenter les capacités thermiques de l’eau. Ainsi l’eau aura plus de faciliter à capter de la chaleur et à en libérer. Lorsque l’on chauffe de l’eau, les liaisons O-H absorbent cette énergie et à contrario lorsque l’on la fait refroidir, elles perdent de l’énergie de manière graduée. L’eau est très résistante aux changements de température, cette caractéristique est très importante pour la régulation thermique des êtres vivants. Elle a besoin de beaucoup d’énergie pour augmenter ou diminuer sa température.
- Solvatation : C’est grâce aux liaisons d’hydrogène que l’eau est un solvant universel. En effet, les molécules d’eau peuvent se construire autour d’une molécule de façon résistante et couvrante afin de l’empêcher de lier à une molécule.
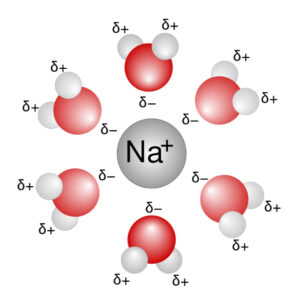 Ion Na solvaté par des molécules d’eau
Ion Na solvaté par des molécules d’eau
- Ainsi les liaisons hydrogènes sont cruciales pour comprendre les propriétés très nombreuses de l’eau. Elles ont une importance dans la structure moléculaire de l’eau et dans les processus chimiques.


